CST Studie, 1. Teil der Studie
Inhaltsverzeichnis
|
Erster Teil: Imidacloprid und Metaboliten
Liste der erfassten Berichte und Veröffentlichungen über Bienenstörungen
Die bibliographische Arbeit hat sich auf die Dokumente gestützt, die vom Ministerium für Landwirtschaft, Ernährung, Fischerei und landwirtschaftliche Belange gesammelt worden sind, sowie auf die Dokumente, die in der wissenschaftlichen Literatur gesucht worden sind. Die Liste dieser Dokumente befindet sich in Anhang I, wo differenziert wird, zwischen den Dokumenten, Versuchsberichten und Zeitungsartikeln, die von der Generaldirektion für Ernährung bereitgestellt worden sind (Nummern Mxx), den Veröffentlichungen aus wissenschaftlichen Zeitschriften mit Lektorat (Nummern Axx) und den technischen Dokumenten (Txx).
Von diesen Dokumenten hat das Ministerium 245 Studienberichte oder zugeordnete Dokumente in Verbindung mit Bienenstörungen bereit gestellt. Von diesen beziehen sich 49 auf Imidacloprid und wurden von Bayer geliefert; 21 Studien, die von den Bayer-Unternehmen, Aventis und Rhone Poulenc geliefert wurden, beziehen sich auf Fipronil. Die Studien, die vom Ministerium bei verschiedenen staatlichen Labors in Auftrag gegeben worden sind, seit Gaucho von den Imkern für das Verschwinden von Bienen verantwortlich gemacht wird, belaufen sich auf 58.
Angaben zu den physikalisch-chemischen Eigenschaften
Die wichtigsten Eigenschaften von Imidacloprid sind anhand der Informationen von Agritox zusammengefasst und waren nicht Gegenstand einer validierenden Studie durch das CST. Wir weisen darauf hin, dass AGRITOX eine Datenbank ist mit Angaben über die physikalisch-chemischen Eigenschaften, die Toxizität, Umwelttoxizität, die Entwicklung in der Umwelt, die vorgeschriebenen Daten der aktiven Substanzen in Pflanzenschutzmitteln, die in Frankreich zulässig sind. Diese Datenbank wurde von der Abteilung Pflanzenschutz und Umwelttoxizität des INRA angelegt. 80% der Informationen entstammen den toxikologischen Unterlagen der Zulassungsanträge, die von den Industrieunternehmen auf französischer und europäischer Ebene eingereicht werden, und 20% entstammen bibliographischen Quellen. In einigen Fällen kann es sein, dass die angegeben Daten nicht mit der internationalen Situation übereinstimmen. Das vollständige Informationsblatt ist in Anhang II beigefügt; Anhang III zeigt die chemischen Strukturen von Imidacloprid und seinen wichtigsten Metaboliten.
Identität
Aktive Substanz: Imidacloprid
Wichtigste biologische Aktivität(en): Insektizid
Chemische Familie: Nitromethylen; Bezeichnungen: Imidacloprid
Chemische Bezeichnungen: 1H-IMIDAZOL-2-AMIN, 1-[(6-CHLOR-3-PYRIDINYL) METHYL]- 4,5-HIHYDRO-N-NITRO-
Kurzformel: C9H10ClN5O2
Strukturformel:
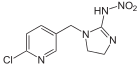
Molekulargewicht: 255,66
Die wichtigsten Metaboliten: 5-Hydroxyimidacloprid, 4-Hydroxyimidacloprid, 4-5 Hydroxyimidacloprid, Olefin, Guanidinderivat, Harnstoffderivat und 6-Chlornikotinsäure.
Physikalische und chemische Eigenschaften
Physikalischer Zustand: kristallisierter Feststoff
Dampfdruck: 0,2 µPa bei 20°C
Löslichkeit in Wasser: 0,58 g/l bei 20°C
Log P = 0,57 (21°C) Stabilität in Wasser: Halbwertzeit: 355 Tage bei einem pH-Wert von 9; sehr stabil bei einem pH-Wert von 5 bis 7; instabil bei einem pH-Wert von 10 bis 14.
Verhalten in der Umwelt
Beständigkeit auf freiem Feld: DT50 (in Tagen): mindestens: 79; maximal: 196
Photochemischer Abbau im Boden DT50 (in Tagen): 171, Lichtquelle: natürlich; Bodenart: unbekannt; Lokalisierung: Land unbekannt, Boden von der Firma ausgewählt.
Adsorption und Desorption (Koc und Kd): Koc – mindestens: 132; Koc maximal: 256.
Vorschriftsmäßige Werte
Toxikologische Einstufung: Xn R22 (Entscheidung der Kommission für Giftstoffe vom 18.11.92).
Gesundheitsschädlich (Xn); R22 giftig im Falle des Verschluckens.
Daten zur Exposition
Angesichts des Problems einer eventuellen Vergiftung von Bienen durch Imidacloprid ist es notwendig, die Mengen dieses Moleküls zu bestimmen, der sie in der Hauptsache durch Sonnenblumenpollen, Maispollen und Sonnenblumennektar ausgesetzt sein könnten. Anschließend ist es angezeigt, die auftretenden Risiken zu bewerten.
Mengenbestimmung von Imidacloprid in den Produkten, die von den Bienen eingesammelt werden. Ein Teil der Untersuchungen, die sich auf die Mengenbestimmung von Imidacloprid im Pollen und im Nektar beziehen, weist Unzulänglichkeiten auf. Aus diesem Grunde können wir nur einige der verfügbaren Ergebnisse validieren. Die gesammelten Daten werden wie folgt präsentiert. Alle verfügbaren Daten werden im ersten Absatz beschrieben. Im zweiten Absatz werden nur die Daten angegeben, die bestimmten Validierungskriterien entsprechen und die für die späteren Phasen herangezogen werden. Ein Absatz schließlich befasst sich mit den oben genannten Kommentaren und der Darlegung der Perspektiven. Diese Präsentation wird für alle Arten von Daten verwendet. Im Allgemeinen geben die in unserem Besitz befindlichen Berichte nicht an, ob die Imidaclopridgehalte in µg/kg Frischgewicht oder Trockengewicht des Pollens oder Nektars angegeben sind. Wenn diese Information bekannt ist, wird sie in den Tabellen angegeben:
Mengenbestimmungen im Pollen
a) Verfügbare Ergebnisse
Zahlreiche Mengenbestimmungen in Pollen wurden unter Verwendung vielfältiger Techniken durchgeführt.
Tabelle I nennt alle Ergebnisse und macht folgende Angaben:
- Arten der Kulturen, die mit Imidacloprid behandelt worden sind (Pflanzen)
- Anzahl der Stichproben, die dosiert worden sind (effektive Anzahl)
- Grenze der Quantifizierung in µg/kg (ppb) (LQ)
- Grenze der Feststellbarkeit in µg/kg (ppb) (LD)
- Die wichtigsten Ergebnisse, die in der Studie enthalten sind
- Bibliographische Verweise
- Laboratorien, die die Analysen angestellt haben.
- Verwendete Technik für die Mengenbestimmung
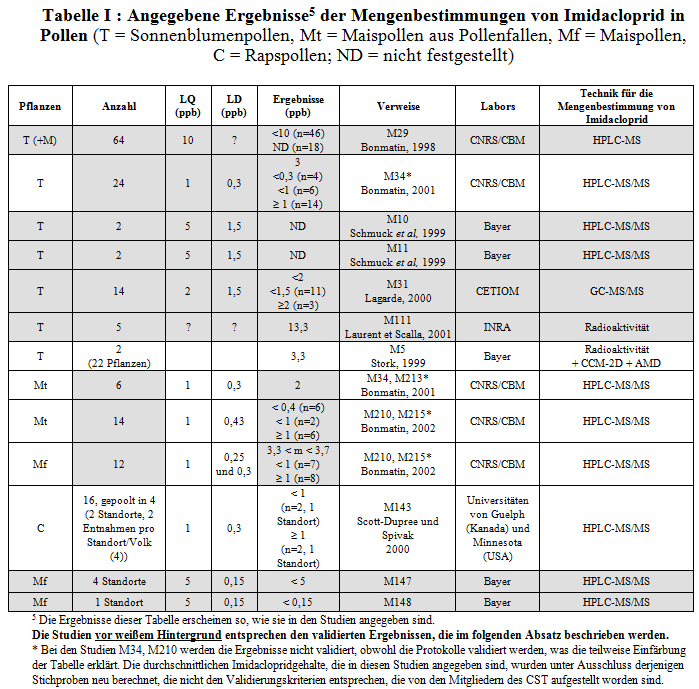
Die Analysen betreffen Sonnenblumenpollen (M34, M29, M5, M31, M10, M11 und M111) und Maispollen (M34, M210, M213, M215, M147 und M148).
Die Ergebnisse der Mengenbestimmungen bei Rapsblütenpollen auf dem amerikanischen Kontinent sind hinweishalber angeführt (M143).
Die Techniken HPLC-MS (M29) und HPLC-MS/MS (M10, M11, M34, M143, M147, M148 und M210) messen nur den Gehalt an Imidacloprid. Die Technik GC-MS/MS (M31) misst den Gesamtgehalt an Rückständen.
Die Studien, die mit Saatgut angestellt worden sind, das mit Imidacloprid gebeizt wurde, das mit C14 markiert worden ist, erfolgen unter besonderen Aussaatbedingungen (M111 und M5). Die Mengenbestimmung der Gesamtradioaktivität ergibt ebenfalls nur den Gesamtgehalt an Rückständen. Gleichwohl hat Stork (1999, M5) diese Untersuchung mit einer Dünnschichtchromatographie in zwei Dimensionen und mit der AMD-Technik kombiniert. Dies hat die Feststellung erlaubt, dass die Radioaktivität im gelösten Teil des Pollens nur in Form von Imidacloprid vorliegt.
Im übrigen möchten die Mitglieder des CST den vorhandenen Unterschied zwischen Pollen aus Pollenfallen und Blütenpollen unterstreichen. Der Pollen aus Pollenfallen, der im Bienenstock selbst geerntet wird, reflektiert die Umwelt des Bienenvolks, weil er aus der Summe der Pollenkugeln der verschiedenen Feldbienen besteht. Wenn der Bienenstock in einem Gebiet mit starker landwirtschaftlicher Nutzung aufgestellt wird, wird der Pollen aus der Pollenfalle homogen sein, weil er aus Pollenkugeln der gleichen Pflanzengattung besteht, die der gleichen Pflanzenschutzbehandlung unterzogen worden sind. Wenn der Bienenstock in einer heterogenen Umgebung aufgestellt wird, kann der Pollen in der Pollenfalle aus Pollenkugeln bestehen, die von unterschiedlichen Pflanzengattungen und/oder identischen Pflanzengattungen mit oder ohne Behandlung mit Gaucho stammen. Aus diesem Grund können die festgestellten Imidaclopridmengen in den Pollenstichproben aus der Pollenfalle unterschätzt werden. Im übrigen stört das Aufstellen von Pollenfallen die Aktivitäten des Bienenvolks. Daher kann es sein, dass die angestellten Mengenbestimmungen anhand von Pollen aus der Pollenfalle nicht repräsentativ sind. Sie werden deshalb bei der Bewertung der Exposition für die Berechnung der Risiken nicht berücksichtigt.
b) Gültigkeit der Ergebnisse
Die Kriterien für die Validierung der Ergebnisse aus der Mengenbestimmung in Pollen, die von den Mitgliedern des CST herangezogen worden sind, lauten wie folgt:
- Nr. 1: eine ausreichende Zahl von Stichproben, die von verschiedenen Standorten stammen. In bestimmten Fällen (Mengenbestimmung in Nektar) können mehrere Versuche zusammengefasst werden, vorausgesetzt die Methoden für die Stichprobenentnahme und Mengenbestimmung sind einheitlich.
- Nr. 2: eine vollständige und eindeutige Vorgeschichte der Stichproben und Methoden für die Stichprobenentnahme, je nach untersuchtem Trägermaterial.
- Nr. 3: die Grenzen der Quantifizierbarkeit und Messbarkeit werden in den Studien angegeben und sind niedrig genug (LQ = 1 ppb; LD < 0,5 ppb).
- Nr. 4: eine spezifische Methode für die Mengenbestimmung von Imidacloprid und seiner Metaboliten, um die Unsicherheiten bei der Risikobewertung zu begrenzen (keine Mengenbestimmung von Gesamtrückständen).
- Nr. 5: ein Stichprobengewicht, das mit dem erforderlichen Gewicht für die Validierung der Methode übereinstimmt.
- Nr. 6: Stichproben, die für die natürlichen Umweltbedingungen repräsentativ sind.
Im übrigen müssen die Beschreibung der Protokolle und die Studienberichte klar und für die Sachverständigen des CST akzeptabel sein. Das Labor CNRS/CBM hat ungefähr die Hälfte der Mengenbestimmungen durchgeführt. Einige der Berichte werfen Fragen auf. Aus diesem Grunde hat sich die Expertengruppe des CST (Arnold, Declercq, Personeni, Rortais und Thybaud) nach Orléans in die Labors des CNRS/CMB (Herr Bonmatin) und des Biotec Centre (privates Labor als Subunternehmer für die Analysen) begeben, um nähere Angaben über die Versuchsmethoden, die Stichprobenentnahme, die Präsentation und die Interpretation der Ergebnisse zu bekommen. Eine Liste der Fragen zu den Methoden und Ergebnissen war den Labors vorab übermittelt worden (Anhänge IV und V). Die wichtigsten Schlussfolgerungen dieses Besuchs sind in Anhang V dargelegt und gelten für alle angestellten Mengenbestimmungen (Pollen, Nektar, Pflanzen und Erdreich). Insbesondere haben die Mitglieder des CST angemerkt, dass in den meisten der gelieferten Berichte Angaben über die genaue Beschaffenheit und Vorgeschichte der Stichproben und/oder über die Anzahl der analysierten Stichproben für einen bestimmten Untersuchungsparameter fehlen. Die den Stichproben entsprechenden Entnahmedatenblätter wurden in der Folge an das CST übermittelt. Eine Verbesserung der Analysemethode zwischen 1998 und den anschließenden Untersuchungen wurde ebenfalls festgestellt.
Mengenbestimmungen in den Sonnenblumenpollen
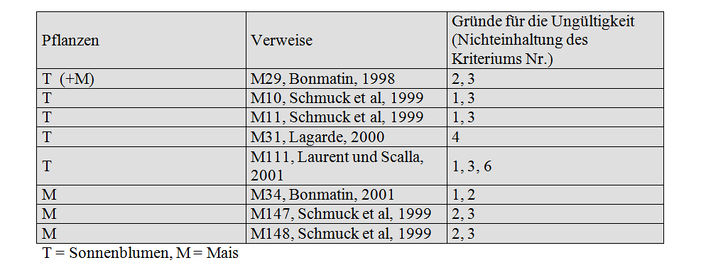
Trotz einer großen Zahl von getesteten Stichproben wurden die Ergebnisse der Untersuchungen des Labors CNRS/CMB (1998, M29) auf Grund der Unsicherheiten hinsichtlich des Pollentyps und auf Grund dessen, dass die Methode, die im Jahre 1998 verwendet worden ist, nicht spezifisch genug war und zu einem hohen LQ (10 ppb) geführt hat, nicht validiert (Anhang VI).
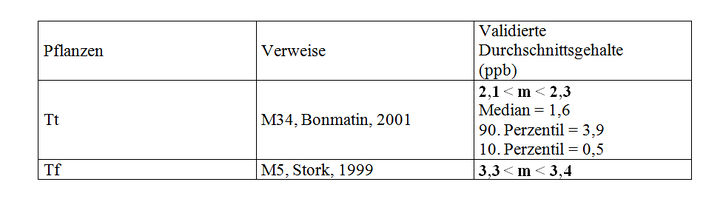
Die Methode HPLC-MS/MS, die ab 1999 entwickelt worden ist, erfüllt die Anforderungen, die an die Spezifizität gestellt werden und ermöglicht eine Quantifizierung von geringen Gehalten (LQ = 1 ppb). Diese Tatsache erlaubt eine Validierung der Mengenbestimmungen von Sonnenblumenpollen (M34), die im Biotec Centre (Anhang VII) angestellt worden sind. Aber auch wenn die entsprechende Studie (M34) validiert worden ist, können wir deren Schlussfolgerungen nicht in ihrer jetzigen Form akzeptieren. Tatsächlich berücksichtigen die Berechnungen der durchschnittlichen Imidaclopridgehalte in den Pollen Pollenstichproben aus Pollenfallen (n=20), eine Stichprobe von Sonnenblumenstaubbeuteln und Stichproben unbekannter Art (n=3). Im Bemühen um Genauigkeit erschien es uns daher notwendig, nur die Pollen aus der Pollenfalle heranzuziehen. Die berechneten durchschnittlichen Imidaclopridgehalte und die Verteilung der 20 Stichproben im Hinblick auf ihren Pestizidgehalt sind in Tabelle II angegeben.

Die durchschnittliche Imidaclopridkonzentration im Pollen aus Pollenfallen in dem mit Gaucho behandelten Gebiet beträgt zwischen 2,1 und 2,3 ppb, der Median beträgt 1,6 ppb.
Von den 20 analysierten Stichproben haben zwei einen Wert unterhalb der Messgrenze (LD = 0,3 ppb), fünf einen Wert unterhalb der Grenze der Quantifizierbarkeit (LQ = 1 ppb) und 13 einen Wert oberhalb dieser Grenze.
Die Studie von Stork (1999, M5), die die Methode der Radioaktivität, gekoppelt mit einer CCM-2D und AMD verwendet, weist eine akzeptable Anzahl von Stichproben (n=22 Stichproben, gepoolt in 2 Partien) und akzeptable Anbaubedingungen auf (Aussaat im Februar in Töpfe). Das Volumen je Pflanze (1300 cm³) ist mit einer Situation auf dem Feld vergleichbar (1300 cm³). Infolge dessen wird sie validiert. Die dosierten Stichproben betreffen Stichproben von Pollen von Sonnenblumen, die mit Gaucho behandelt worden sind. Der durchschnittliche Gehalt beträgt 3,3 ppb. In dieser Studie wurde kein Metabolit festgestellt.
Die Studie von Lagarde (2000, M31) legt eine Analyse mit Gesamtrückständen vor und keine Analyse von Imidacloprid allein. Allerdings stimmen die Ergebnisse mit denen von Bonmatin (2001, M34) überein und verleihen allen diesen Analysen Glaubwürdigkeit.
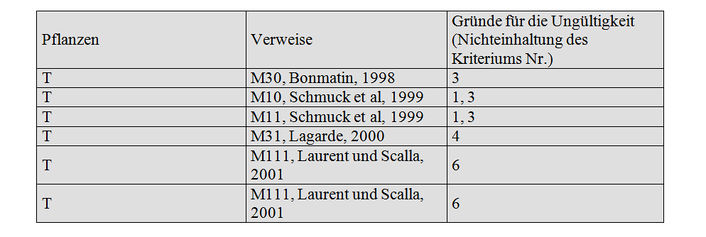
Die Studien von Schmuck et al. (1999, M10 und M11) und diejenigen von Laurent und Scalla (2001, M111) werden wegen einer geringen Zahl von Stichproben, eines hohen LQ (LQ= 5ppb bei M10 und M11) oder unbestimmten LQ (M111) und nicht optimalen Bedingungen für den Anbau der Sonnenblumen (Aussaat im Juli und Ernte im Oktober, mangelhaftes Wachstum der Pflanzen) (M111) nicht validiert.
Mengenbestimmungen in Maispollen
Bei den Mengenbestimmungen in Maispollen wurden zwei Serien von Stichprobenentnahmen (1998-1999; 2000) angestellt, die Anlass zu 2 Serien von Analysen durch das Biotec Centre gegeben und zu zwei Studien M34 (Bonmatin, 2001) und M210 (Bonmatin, 2002) geführt haben. Anlässlich der Studie M34 wurden 10 Stichproben entnommen, wovon 6 auf Pollen aus Pollenfallen in einem Gebiet mit Gaucho-Mais, 2 auf Rispen von Mais, der mit Gaucho behandelt worden ist und 2 auf Stichproben unbekannter Art entfallen (Anhang VII). Anhand der Datenblätter über die Stichprobenentnahmen wurden Unsicherheiten bezüglich der Beschaffenheit und vorgenommenen Behandlungen festgestellt. Die Anzahl der unzweideutigen Stichproben ist somit zu gering (n=3 beim Pollen aus Pollenfallen, n=2 beim Pollen aus Maisrispen). Deshalb wird die entsprechende Studie (M34) im Hinblick auf die Mengenbestimmungen von Imidacloprid in Maispollen nicht validiert.
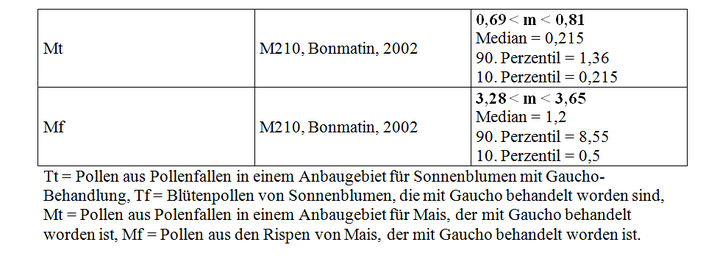
Dagegen basiert die Studie M210 (Bonmatin, 2002; Anhang VIII) mehrheitlich auf Stichproben, die von Testapi entnommen worden sind und eine gute Rückverfolgbarkeit aufweisen. Gleichwohl sind einige der Stichproben, die in diesem Bericht M210 präsentiert werden, Stichproben, die im Jahre 1998 entnommen und getestet worden sind (Studie M34) und im Jahre 2000 erneut analysiert wurden. In Anbetracht der voranstehend erwähnten Unsicherheiten in Verbindung mit diesen Stichproben berücksichtigen wir sie in der weiteren Folge der Bewertung nicht.
Die Analysemethode der Studie M210 hält sich an die Kriterien, die von den Mitgliedern des CST aufgestellt worden sind. Diese Studie wird somit validiert, jedoch unter dem Vorbehalt, dass nur die von Testapi entnommenen Stichproben berücksichtigt werden und die Stichproben, die aus der Studie M34 stammen, unberücksichtigt bleiben. Die berücksichtigten Stichproben sind Stichproben von Pollen aus Pollenfallen oder Stichproben von Pollen aus Rispen. Ihre Beschreibung befindet sich in Anhang VIII.
Die berechneten durchschnittlichen Gehalte und die Verteilungen der ausgewählten Stichproben sind in Tabelle III angegeben.
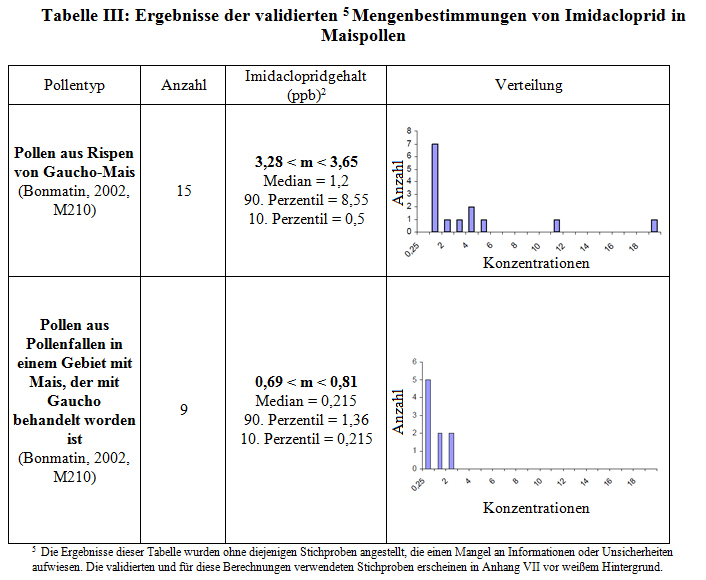
Es war nicht möglich, Rückschlüsse hinsichtlich des Vorhandenseins von Imidacloprid im Pollen von Mais zu ziehen, der aus einem Anbau stammt, der im Jahr vor der Stichprobenentnahme mit Gaucho behandelt worden ist und im Jahr der Stichprobenentnahme nicht behandelt wurde, weil die Anzahl der validierten Stichproben zu gering war (n=1 beim Blütenpollen, n=0 beim Pollen aus Pollenfallen).
Was die Studien M147 und M148 (Bayer) anbelangt, handelt es sich um Studien im Vorfeld des Antrags auf Zulassung von Gaucho, wobei die Grenze der Quantifizierbarkeit 5 ppb beträgt. Diese Studien werden nicht validiert. Im übrigen haben wir keinerlei Angaben zur Anzahl der Stichproben, zu ihrem Gewicht usw. erhalten.
3 Der Durchschnittswert (m) wird durch einen Mindestwert und einen Höchstwert eingerahmt, die jeweils anhand der Grenzwerte für die Quantifizierbarkeit und Messbarkeit berechnet worden sind.
Wenn LD zum Beispiel 0,3 ppb und LQ = 1 ppb beträgt, wird eine Stichprobe A mit einem Imidaclopridgehalt < LD mit den Werten 0 und 0,3 ppb eingerahmt.
Eine Stichprobe B mit einem Imidaclopridgehalt < LQ wird einen Wert zwischen 0,3 und 1 ppb besitzen.
Bei der Stichprobe A wird der Median unter Heranziehung des Wertes LD/2 berechnet, bei der Stichprobe B lautet der Wert LQ/2. Diese Vereinbarungen gelten für unsere sämtlichen Schätzungen.
Mengenbestimmung in Rapspollen
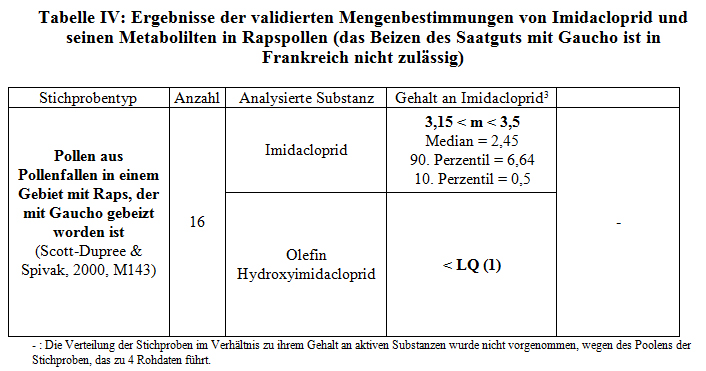
Die Studie M143 (Scott-Dupree et al, 2000) verweist auf Mengenbestimmungen in Pollen aus Pollenfallen in einem Gebiet mit Raps, der mit Gaucho behandelt worden ist. Die Studie hat in den USA stattgefunden, wo das Beizen von Raps zulässig ist. Diese Behandlung ist in Frankreich nicht zugelassen. Zwei Stichprobenentnahmen pro Bienenstock an jedem der beiden Standorte wurden vorgenommen. Die Entnahmen aus den 4 Bienenstöcken wurden sodann gepoolt. Wie bei der Studie von Stok (M5, 1999) halten wir die Anzahl der Stichproben für zufriedenstellend. Die Grenzen der Quantifizierbarkeit und Messbarkeit betragen jeweils 1 ppb und 0,3 ppb. Diese Studie wird somit validiert. Allerdings wird darauf hingewiesen, dass diese Studie auf einen kanadischen Frühjahrsraps bezug nimmt, der nicht mit dem in Frankreich angebauten Winterraps vergleichbar ist.
c) Kommentare und Perspektiven
Die Validierung der Daten aus den Berichten des Labors CNRS/CBM ermöglicht die Schlussfolgerung, dass die Mengen an Rückständen von Imidacloprid in den Pollen aus Pollenfallen in einem Gebiet mit Sonnenblumen, die mit Gaucho behandelt worden sind, zwischen 2,1 und 2,3 ppb beträgt. Bei den Pollen, die aus Sonnenblumen entnommen worden sind, die mit Gaucho behandelt wurden, ergibt die Studie von Stork einen Imidaclopridgehalt von 3,3 ppb.
Bei den Poolen aus Rispen von Mais, der mit Gaucho behandelt worden ist, gelangen wir zu Imidaclopridgehalten zwischen 3,28 und 3,65 ppb. Für Maispollen müssen Szenarien für eine Vergiftung auf topischem und oralem Weg aufgestellt werden.
Was den Maispollen betrifft, zeigen die Analysen an Pollen aus Pollenfallen in einem Gebiet, in dem der Mais mit Gaucho behandelt worden ist, unter den Versuchsbedingungen Imidaclopridrückstände zwischen 0,69 und 0,81 ppb.
Die Analysen von Rapspollen aus Pollenfallen in einem Gebiet mit Gaucho-Behandlung zeigen durchschnittliche Imidaclopridgehalte, die mit denen vergleichbar sind, die bei Pollen aus Pollenfallen in einem Anbaugebiet für Sonnenblumen gemessen worden sind und belaufen sich auf 3,15 bis 3,5 ppb.
Es scheint somit ein Unterschied zwischen den Pollen aus Pollenfallen in einem Maisanbaugebiet und solchen aus Anbaugebieten für Sonnenblumen und Raps zu bestehen.. Gleichwohl stammen die Pollen aus Pollenfallen aus einer Mischung von Pollen, die von mehreren Blütenarten stammen, die mit Gaucho behandelt worden sind oder auch nicht. Somit könnten sich die unterschiedlichen Imidaclopridkonzentrationen, die zwischen den Pollen aus Pollenfallen beobachtet worden sind, durch ein Übergewicht beim Absammeln von Sonnenblumen erklären, während Mais weniger attraktiv ist, wobei der Maispollen mit den Pollen von anderen Blüten vermischt wäre, die nicht notwendigerweise mit Gaucho behandelt worden sind. Die Arbeiten der zoologischen Abteilung des INRA Le Magneraud (Odoux et al, M159) bestätigen diese Hypothese. Abbildung 1 zeigt eine Überlagerung des Vorhandenseins von Sonnenblumenpollen und Maispollen in der 2. Julihälfte.
Abbildung 1: Analyse des Pollens in Pollenkugeln von Bienen, die in Pollenfallen geerntet worden sind (nach Odoux et al, 2003; M159):
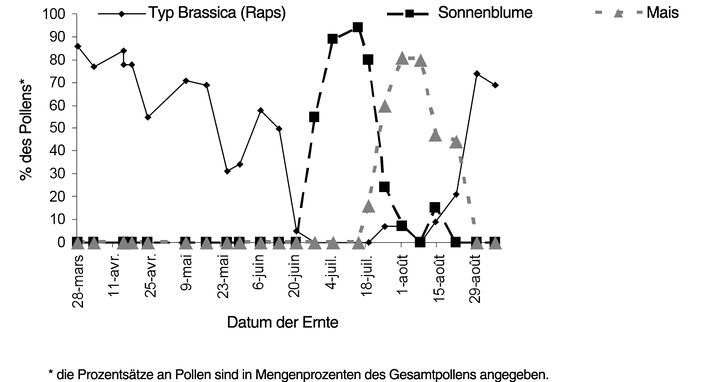
Im übrigen kommen wir nicht umhin die Tatsache zu bedauern, dass keine Studie in bezug auf die Inhaltsmengen an Rückständen der Metaboliten von Imidacloprid in den Pollen von Sonnenblumen und Mais validiert werden konnte. Die Metaboliten besitzen eine eindeutige Toxizität für die Bienen. Das betrifft insbesondere Olefin (siehe Absatz 4). Desgleichen konnten wegen der mangelhaften Kontrolle der Stichprobenentnahme keinerlei Schlussfolgerungen über das Vorhandensein von Imidacloprid in den Pollen aus Pollenfallen in einem Anbaugebiet für Sonnenblumen oder Mais infolge einer Behandlung mit Gaucho in dem oder in den Jahren vor der Stichprobenentnahme gezogen werden. Das CST empfiehlt, die Stichprobenentnahmen künftig unter Beachtung der guten Laborpraktiken (BPL) vorzunehmen. Es wäre auch notwendig, dass die Labors in der Lage sind, den Gehalt an Metaboliten des Imidacloprids (Hydroxyimidacloprid, Olefin, Dihydroxyimidacloprid, Harnstoffderivat, Guanidinderivat) mit ausreichend niedrigen Grenzen für die Quantifizierbarkeit und Messbarkeit (< 1 ppb) zu bestimmen.
Mengenbestimmungen im Nektar
a) Verfügbare Ergebnisse
Mit den gleichen Techniken, wie für die Analyse von Pollen, wurde der Gehalt von Imidacloprid auch im Nektar von Sonnenblumen (M28, M37, M10, M11, M31, M5) und Raps (M143) bestimmt. Alle Ergebnisse sind in Tabelle V angegeben.
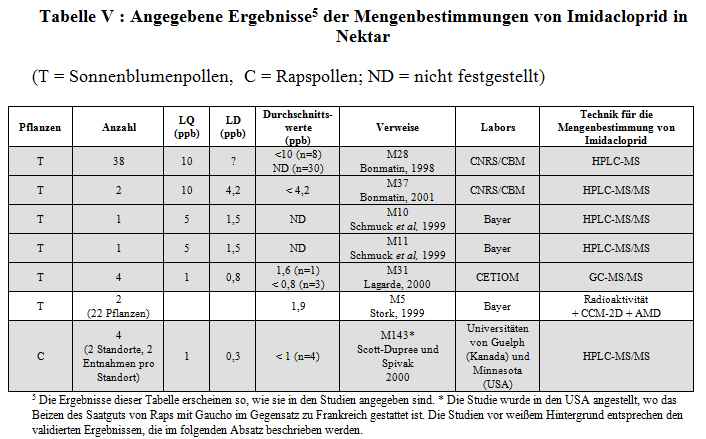
Anzumerken ist, dass die Matrix anders ist und die Extraktionstechniken deshalb nicht zu einem so geringen LQ geführt haben, wie beim Pollen (M28 und M37) im Falle der Untersuchungen, die von der Firma Biotec für das Labor CNRS/CBM angestellt worden sind. Gleichwohl gelingt es einem Labor (Universität Guelph und Universität Minnesota), sachdienliche Grenzen für die Quantifzierbarkeit und Messbarkeit zu erreichen.
b) Gültigkeit der Ergebnisse
Die Kriterien für die Validierung sind mit denen identisch, die für die Mengenbestimmungen von Imidacloprid in Pollen verwendet worden sind.
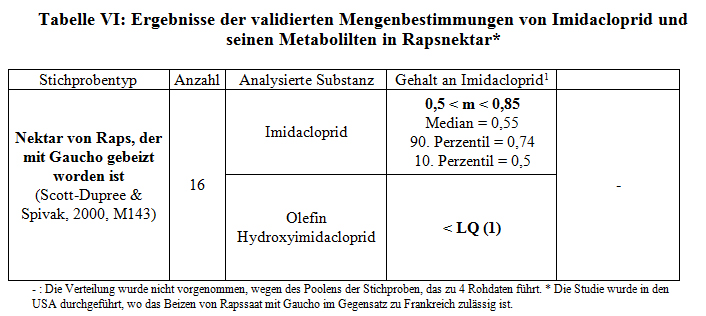
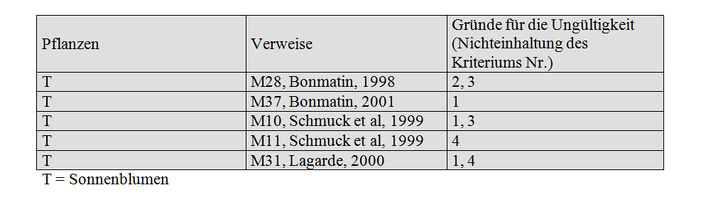
Trotz einer großen Zahl von Stichproben werden die Mengenbestimmungen im Nektar in den Bienenstöcken, die vom Labor CNRS/CBM im Jahre 1998 (M28) angestellt worden sind, aus den gleichen Gründen nicht validiert, die für die Mengenbestimmungen im Pollen im Jahre 1998 gelten (Methode nicht spezifisch genug, hoher LQ). Im Jahre 2001 hat dieses Labor nur zwei Stichproben von Nektar von Sonnenblumen getestet, die mit Gaucho behandelt waren. Diese Stichproben besitzen eine geringere Masse, als sie für die verwendete Technik erforderlich ist (M37); diese Ergebnisse werden deshalb nicht akzeptiert. Ebenso wie bei der Mengenbestimmung in Pollen weisen die Studien von Schmuck (M10 und M11) eine zu hohe LQ (5 ppb) auf. Die Studie von Lagard (M31) basiert auf einer zu geringen Zahl von Stichproben (n=4) und gibt nur den Gehalt an Gesamtrückständen an. In Anbetracht dieser Unzulänglichkeiten können diese Studien nicht validiert werden. Die Studie von Stork (M5) basiert auf einer ausreichenden Zahl von Stichproben (11 Stichproben, gepoolt in 2 Partien). Infolge dessen validieren wir diese Studie und den Gehalt von 1,9 ppb an Imidacloprid im Sonnenblumennektar (die Berechnung des Medians ist wegen des Fehlens der Rohdaten nicht möglich). Beim Nektar von Raps, der mit Gaucho behandelt worden ist (was in Frankreich nicht zulässig ist), validieren wir die Studie M143 (Tabelle VI) bezüglich der Mengenbestimmung von Imidacloprid und 2 seiner Metaboliten.
c) Kommentare und Perspektiven
Es ist notwendig, weitere Stichprobenentnahmen (BPL) und Mengenbestimmungen in Betracht zu ziehen und vorrangig ein oder mehrere Labors zu finden, die in der Lage sind, die Menge an Imidacloprid allein im Nektar zu bestimmen, unter Berücksichtigung der Besonderheiten der Matrix und der Schwierigkeiten, Nektar in großer Menge zu bekommen. Eine Ausnahmeregelung für den Anbau von Sonnenblumen mit Gaucho-Behandlung unter der Voraussetzung der Einkapselung der Blütenstände, um jeden Kontakt mit den Bienen zu vermeiden, muss vorab getroffen werden. Im übrigen wäre es von Nutzen, Mengenbestimmungen von Imidacloprid im Honig vorzunehmen, um festzustellen, was mit dem Wirkstoff im Laufe der Umwandlung von Nektar in Honig und im gelagerten Honig passiert.
Mengenbestimmungen im von Imidacloprid im Erdreich und Remanenz
a) Verfügbare Ergebnisse
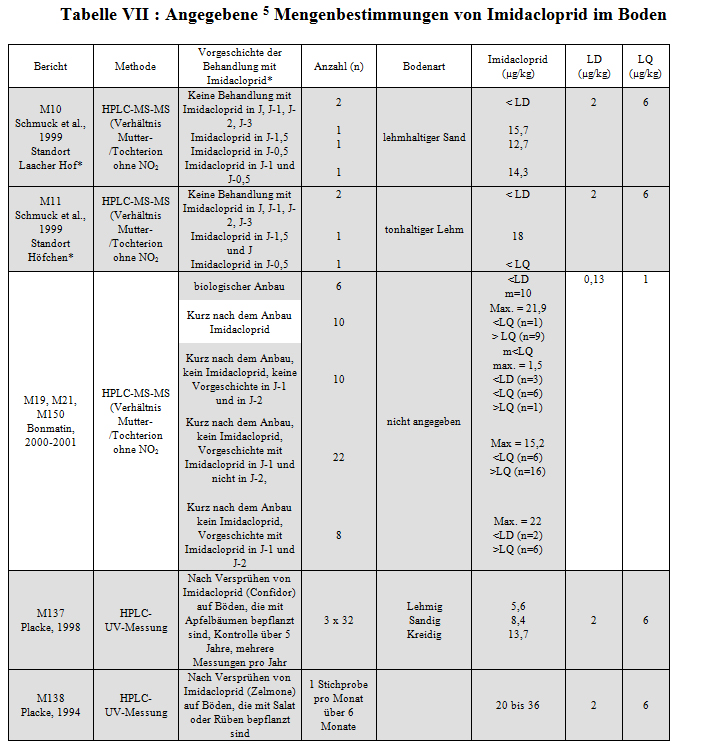
In den Laborstudien, die im Rahmen des Antrags auf Genehmigung der Vermarktung von Imidacloprid angestellt worden sind, beträgt die Halbwertzeit dieser Substanz 188±25 Tage auf sandig-lehmigem Boden und 249±50 Tage auf hochfeinem, lehmigem Boden (M22). Seine Fähigkeit zur Anreicherung im Boden ist gering (Adsorptionskonstante von 1,17 bis 3,59). Dagegen ist Imidacloprid sehr lichtempfindlich (M22). Auf freiem Feld (M76) beträgt die Halbwertzeit 140±41 Tage auf nacktem Boden (n=10), und zwei Studien auf kultiviertem Boden ergeben eine Halbwertzeit von 102 und 125 Tagen. Anzumerken ist, dass wir für diese Studie nur über die Rohergebnisse verfügen. Dieses Molekül ist somit persistent im Sinne der Verordnung. Eine Mitteilung der Behörde für die Regelung der Parasitenbekämpfung in Kanada (M255) ergibt eine längere Halbwertzeit (1 bis 2 Jahre) unter den Bedingungen des Feldanbaus, aber wir verfügen nicht über die entsprechenden Ergebnisse. Diese Ergebnisse können sich durch die Tatsache erklären lassen, dass die Böden in den Rapsanbaugebieten gefroren oder sehr kalt bleiben und somit während des größten Teils des Jahres nur geringe mikrobielle Aktivitäten für den Abbau von Imidacloprid vorhanden sind. Mengenbestimmungen im Erdreich wurden auch auf Parzellen angestellt, die in den vorangegangenen Jahren mit Imidacloprid behandelt worden sind oder nicht. Diese Mengenbestimmungen wurden einerseits von der Firma Bayer für Probenentnahmen vor der Aussaat des Jahres A und andererseits vom Labor CNRS/CBM und von der Firma Biotec-Centre für Probenentnahmen nach dem Anbau im Jahre A angestellt. Die Ergebnisse und die Vorgeschichte der Stichproben sind in Tabelle VII angegeben. Die Berichte, die sich in unserem Besitz befinden, enthalten keine Angaben darüber, ob die Gehalte an Imidacloprid in µg/kg Frischgewicht oder Trockengewicht des Bodens angegeben sind.
b) Gültigkeit der Ergebnisse
Die Validierungskriterien sind mit denen identisch, die für die Mengenbestimmungen in Pollen festgelegt worden sind.
Die verwendete Technik für die Mengenbestimmungen in diesen Studien ist HPLC-MS/MS, die voranstehend als spezifischste und empfindlichste Technik für die Mengenbestimmung von Imidacloprid allein beschrieben worden ist. Das bei Herrn Bonmatin (Labor CNRS/CBM) angestellte Audit hat die Validierung dieser Technik sowie der Grenzen der Messbarkeit und Quantifizierbarkeit ermöglicht, die für die Studie 1999-2000 (M19, M21, M150) beschrieben worden sind.
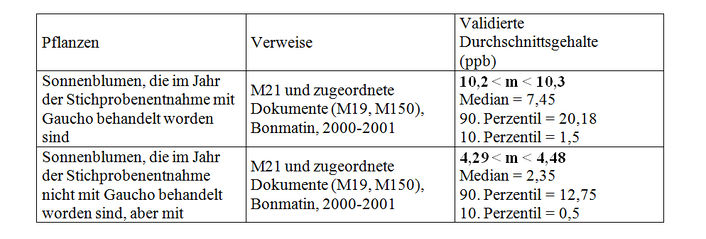
Es war schwierig, die Vorgeschichte der Bodenstichproben zu bekommen, die für die Analysen des Labors CNRS/CBM entnommen worden sind. Allgemein haben die im Nachhinein gelieferten Entnahmedatenblätter (M211) eine Verbesserung der Kenntnis der Stichproben ermöglicht. Die in diesen Datenblättern enthaltenen Informationen konnten häufig durch diejenigen ergänzt werden, die in den Datenblättern über die Stichprobenentnahme aus den Pflanzen (M212) angegeben waren, wenn Boden und Pflanzen am gleichen Standort entnommen wurden. Anhang IX zeigt alle Ergebnisse der Einzelstichproben mit der bekannten Vorgeschichte im Hinblick auf eine Behandlung mit Gaucho oder nicht und die verschiedenen Kulturen. Allerdings sei angemerkt, dass Unsicherheiten bezüglich der Vorgeschichte der Stichproben bestehen. Gleichwohl stimmt die Technik für die Mengenbestimmung von Imidacloprid, die in dieser Studie verwendet worden ist, mit den vom CST aufgestellten Validierungskriterien überein. Die Studie wird daher validiert, obwohl die sich daraus ergebenden Schlussfolgerungen in Frage gestellt werden. Indem nur diejenigen Stichproben berücksichtigt werden, deren Vorgeschichte und Beschaffenheit eindeutig bekannt sind, erhalten wir die folgenden durchschnittlichen Gehalte an Imidacloprid und Stichprobenverteilungen (Tabelle VIII): 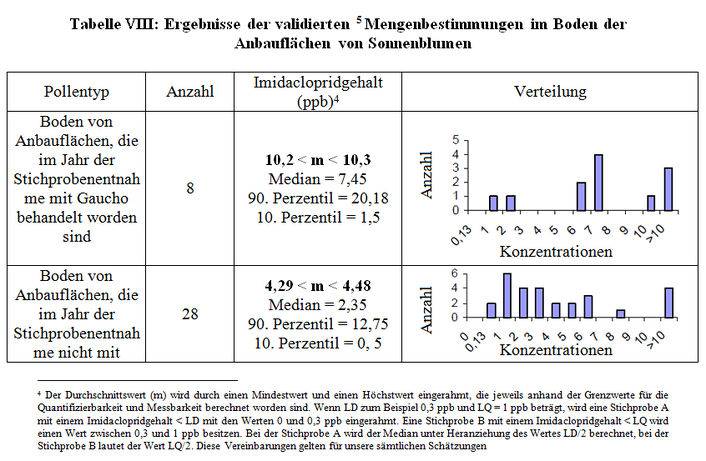
Schlussfolgerung:
- Kurz nach einer Kultur, die mit Imidacloprid behandelt worden ist, finden wir das Molekül noch immer in einer Menge von 10,2 bis 10,3 ppb (n=8).
- 1 Jahr nach der letzten Behandlung mit Imidacloprid beträgt der durchschnittliche Gehalt im Boden 4,3 bis 4,5 ppb.
Wir weisen darauf hin, dass diese beiden Schlussfolgerungen mit denen übereinstimmen, die vom Autor dieser Studie gezogen worden sind. Allerdings werden die Schlussfolgerungen bezüglich der Anreicherungsphänomene im Anschluss an mehrere aufeinanderfolgende Behandlungen mit Gaucho und den Einfluss der laufenden Kultur wegen der zu geringen Anzahl von Stichproben nicht bestätigt. Tatsächlich wurden in dieser Studie nur 8 Stichproben von dem Boden entnommen, in das in 2 aufeinanderfolgenden Jahren Saatgut eingesät worden ist, das mit Gaucho behandelt wurde (Anhang IX). Die Schlussfolgerungen bezüglich des Einflusses der laufenden Kultur basieren auf 4 Stichproben beim Mais und 6 bei Sonnenblumen. Die Studien von Schmuck et al. (1999, M10 und M11) weisen nur eine geringe Anzahl von Stichproben und eine hohe LQ auf und können daher nicht validiert werden. Allerdings bestätigen die erzielten Ergebnisse diejenigen der Berichte M19 und M21 (Bonmatin, 2000, 2001).
Die Studien M137-M138 (Placke, 1994, 1998), die von Bayer ausgeführt worden sind, legen dar, was mit Imidacloprid im Boden passiert und den eventuellen Transfer auf die nachfolgenden Kulturen. Sie enthalten jeweils eine Bestimmung des Verhaltens von Imidacloprid im Boden während 6 aufeinanderfolgender Jahre nach Anwendung von Confiror und eine sechsmonatige Kontrolle der Imidaclopridgehalte im Boden bei Fruchtwechsel (Anwendung von Zelmone). Die Studie M137 gelangt zu einem Anstieg des Imidaclopridgehalts i mBoden während der ersten 3 Jahre und sodann zu einem Plateaueffekt. Ebenfalls festzustellen ist die Variabilität der Abbaubarkeit je nach Bodentyp. Die Studie M138 gelangt zu einer Verringerung der Imidaclopridmenge im Boden um 50% nach Ablauf von 6 Monaten. Trotz des Interesses dieser Studien werden wir sie für unsere Bewertung nicht berücksichtigen, wegen der Besonderheit der Behandlungen, die nicht unserem Fall des mit Gaucho gebeizten Saatguts entsprechen.
c) Kommentare und Perspektiven
Das Interesse einer Analyse der Imidaclopridgehalte im Boden wäre die Bewertung der Rückstandsmenge, die von den Pflanzen im Laufe späterer Jahre aufgenommen werden könnte. Im Falle des mit Gaucho gebeizten Saatgutes hat uns nur die Studie des Labors CNRS/CBM (Bonmatin, 2001, M21) die Möglichkeit gegeben, eine Verringerung der Imidaclopridrückstände im Boden im Jahr nach der Behandlung um 50% zu veranschlagen. Wegen der geringen Zahl von Stichproben ist es leider nicht möglich, Schlüsse in bezug auf mehrere aufeinanderfolgende Jahre zu ziehen. Gleichwohl scheint im Falle des aufeinanderfolgenden Versprühens von Imidacloprid auf den Boden laut Abbildung 2, die anhand der Ergebnisse der Studien von Placke (M137, M138) erstellt worden ist, Anreicherungsphänomene von Jahr zu Jahr anzuzeigen. Die Imidaclopridmenge, die im Boden vorhanden ist, nimmt im Laufe der 3 ersten Jahre zu und stabilisiert sich danach an 2 von 3 Standorten.
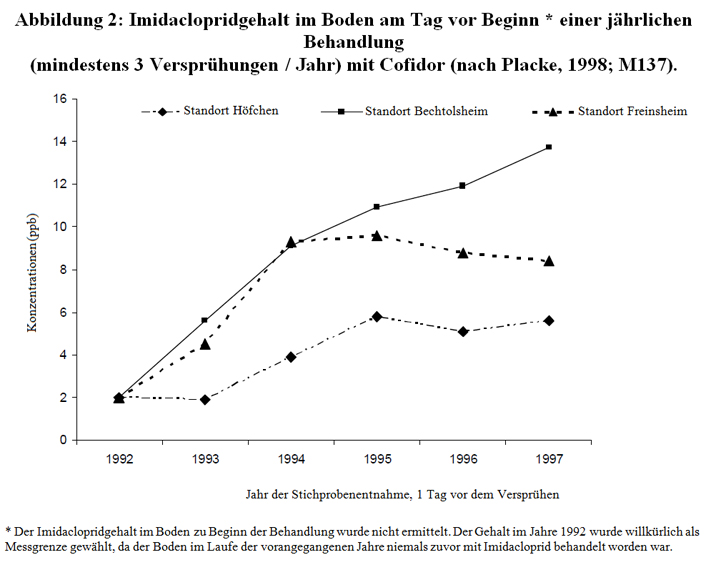
Diese Anreicherungsphänomene bei aufeinanderfolgenden Behandlungen mit Gaucho würden eine erneute Untersuchung verdienen, und zwar im exakten Fall des Saatguts von Sonnenblumen und Mais, das mit Gaucho behandelt worden ist, mit besonderer Sorgfalt bei der Kontrolle der Stichprobenentnahme.
Weitere Entwicklung von Imidacloprid in der Pflanze
a) Verfügbare Ergebnisse
Sonnenblumen
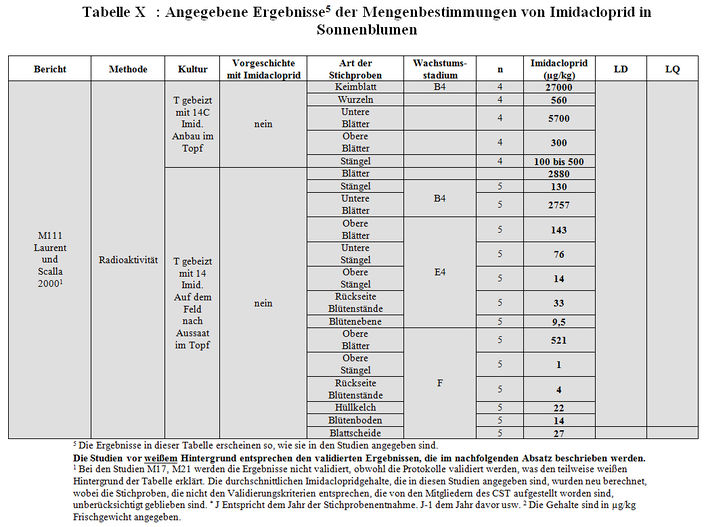
Zahlreiche Studien die die Techniken verwenden, die bereits bei den Mengenbestimmungen im Pollen dargelegt worden sind, haben zu einer Bewertung der Imidaclopridgehalte in Sonnenblumen mit Gaucho-Behandlung oder ohne Gaucho-Behandlung, aber mit Anpflanzung an einem Standort mit Gaucho-Vorgeschichte geführt. Sie wurden vom Labor CNRS/CBM und von der Gesellschaft Biotec (M30, M17, M21 und M150), von der Gesellschaft Bayer (M10 und M11), von CETIOM (M31) und vom INRA in Toulouse (M111) angestellt. Alle Ergebnisse sind in Tabelle IX zusammengefasst. Anhang X erläutert die Codes, die für die Wachstumsstadien verwendet worden sind. Bei der Mehrzahl der Studien enthalten die in unserem Besitz befindlichen Berichte keine Angaben darüber, ob die Imidaclopridgehalte in µg/kg Frischgewicht oder Trockengewicht der Pflanze angegeben sind. Wenn diese Information bekannt ist, ist dies in der Tabelle angegeben.
Es besteht eine erhebliche Heterogenität bei den Bedingungen für den Anbau, den analysierten Pflanzenteilen, den Wachstumsstadien, in denen die Entnahmen erfolgt sind sowie bei den Quantifizierungsgrenzen der verschiedenen Analyseprotokolle. Es ist deshalb schwierig, diese Studien miteinander zu vergleichen.
Andere Pflanzen als Sonnenblumen
Das Labor CNRS/CBM hat sich auch für die Bestimmung der Imidaclopridmenge in Gaucho-Mais, oder in nicht behandelten Kulturen, wie Mais, Weizen, Raps und Luzernen interessiert, die auf Feldern ausgesät worden sind, die zuvor mit Imidacloprid behandelt worden waren (2000, M17, M21, M150; 2002, M209, M212, M214) (siehe Tabelle X). 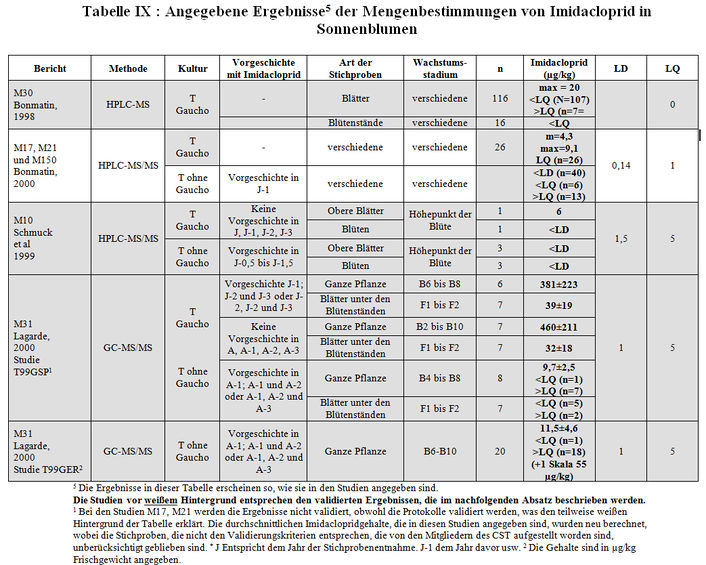

b) Gültigkeit der Ergebnisse
Sonnenblumen
Ebenso wie bei den Mengenbestimmungen in Pollen ist festzustellen, dass die Studien, die 1998 vom Labor CNRS/CBM (30) angestellt worden sind, nicht mit unseren Qualitätskriterien übereinstimmen, weil die verwendete Technik weder spezifisch genug, noch genau genug ist (LQ = 10). Anhang XI nennt dennoch die angestellten Einzelanalysen mit der bekannten Vorgeschichte der Stichproben. Bei den Studien, die im Jahre 2000 angestellt worden sind (M17, M21, M150) war es ebenso wie bei den Bodenuntersuchungen schwierig, die Vorgeschichte einer Reihe von Stichproben zu erhalten. Der Vergleich der Rohdaten aus den Berichten M17 und M21 mit den kompletten Entnahmedatenblättern (2002, M212) zeigt eine Reihe von Unsicherheiten, die es uns nicht erlauben, diese Stichproben zu validieren (siehe Anhang XII). Man kann allerdings bereits sagen, dass eine Reihe von Stichproben, die im Bericht M17 angegeben sind, Stichproben sind, die bereits 1998 entnommen und getestet wurden und im Jahre 2000 mit einer optimierten Technik erneut getestet worden sind.
Soweit es Sonnenblumen betrifft, interessiert sich das Labor CNRS/CBM im Bericht M21 für die Bioverfügbarkeit von Imidacloprid in Sonnenblumen in Abhängigkeit vom Wachstumsstadium, von der Pflanzensorte und von der Insektiziddosis, die für das Beizen des Saatguts verwendet worden ist. Leider haben wir eine Reihe von Problemen bei der Analyse der Ergebnisse festgestellt (Tabelle XI), die es uns nicht erlauben, die Schlussfolgerungen des Autors dieser Gutachten zu bestätigen.

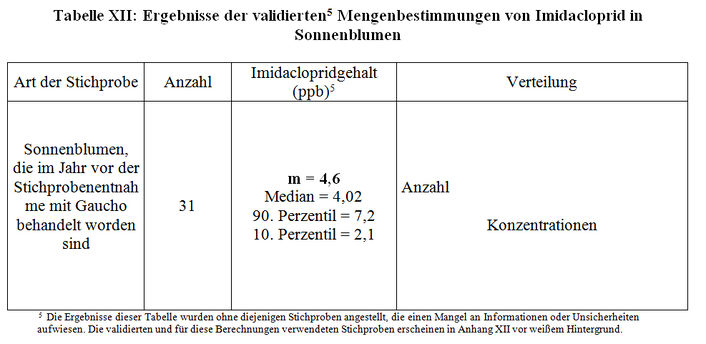
Obwohl die Schlussfolgerungen der Studien M17 und M21 unserer Ansicht nach hinfällig sind und nicht validiert werden, wurden die von Biotec angestellten Mengenbestimmungen dennoch anhand einer von CST validierten Methode vorgenommen. Indem wir diejenigen Stichproben weggelassen haben, die eine mangelhafte Rückverfolgbarkeit aufweisen und die voranstehend angegebenen analytischen Probleme korrigiert haben, haben wir den Imidaclopridgehalt in Sonnenblumen mit Gaucho-Behandlung im Jahr der Stichprobenentnahme neu berechnet (Tabelle XII). Diese Gehalte entsprechen den durchschnittlichen Inhaltsmengen an Imidacloprid in der gesamten Pflanze. Sie dürfen nur hinweishalber herangezogen werden, weil die Berechnungen mit Stichproben unterschiedlicher Beschaffenheit (Kopf, Blütenstand, Stängel, Blätter) und unterschiedlichen Wachstumsstadien erfolgt sind. Es war nicht möglich, die Restgehalte an Imidacloprid in Sonnenblumen ohne Gaucho-Behandlung zu berechnen, weil Angaben über die Behandlung in den Vorjahren fehlten.
Die Studien von Bayer (M10 und M11) weisen eine zu geringe Zahl von Stichproben sowie eine hohe LQ auf und können daher nicht validiert werden. Dies gibt uns jedoch einen Hinweis auf die potenziell beobachteten Gehalte in Sonnenblumen mit Gaucho-Behandlung. Diese Angaben sind mit den Mengenbestimmungen des Labors CNRS/CBM zu korrelieren.
Die Studien des CETIOM (M31) geben einen Imidaclopridgehalt in den oberen Blättern der behandelten Sonnenblumen an, der höher ist, als derjenige, der in den Studien von Bayer oder des Labors CNRS/CBM angegeben ist. Die Untersuchungen bezüglich der Remanenz bei ganzen Sonnenblumenpflanzen auf einem Feld mit Gaucho-Vorgeschichte geben bei insgesamt 28 Stichproben einen durchschnittlichen Imidaclopridgehalt in einer Größenordnung von 10 µg/kg in den Stadien B4-B10 an . Allerdings betreffen diese Mengenbestimmungen Gesamtrückstände. Die Studien wurden deshalb nicht validiert.
Die Studien, die von Laurent und Scalla (M111) beim INRA in Toulouse angestellt worden sind, wurden unter Bedingungen mit abgeschlossener Aussaat angestellt. Darüber hinaus erfolgte die Aussaat im Juli, was die normalen Wachstumsbedingungen bei Sonnenblumen nicht widerspiegelt. Diese Studie kann daher nicht validiert werden.
Mais
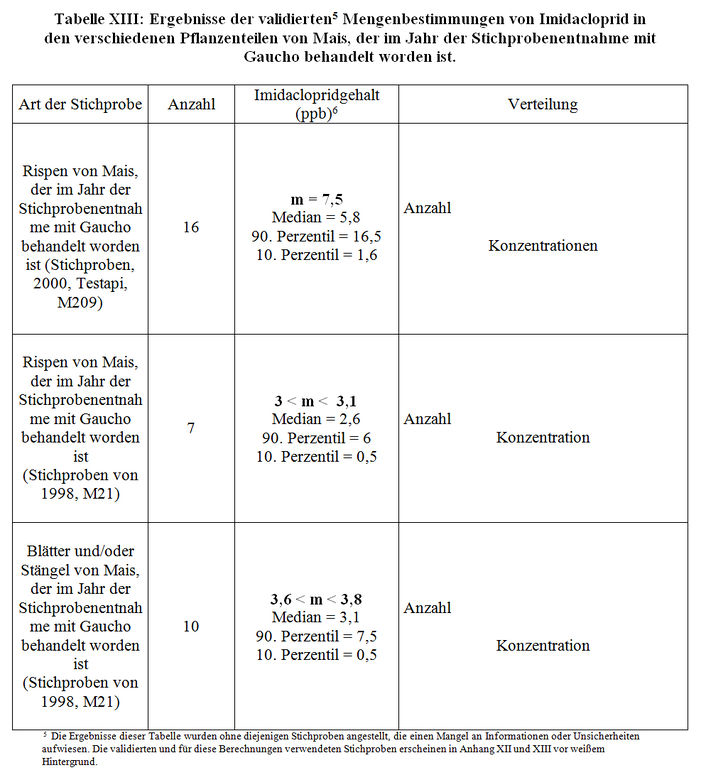
Die Ergebnisse, die in den Studien des Labors CNRS/CBM (M17, M21, M150) aus dem Jahre 2000 angegeben sind, können nicht validiert werden, soweit es den Mais betrifft, wegen der Berücksichtigung einer Reihe von Stichproben, die hinsichtlich ihrer Behandlung, Beschaffenheit usw. Zweifel aufweisen. Gleichwohl entspricht die Methode für die Mengenbestimmung den Validierungskriterien des CST. Diejenigen Stichproben, die eine gute Rückverfolgbarkeit aufweisen, können somit berücksichtigt werden (siehe Anhang XII). Der Bericht M209 desselben Labors berücksichtigt 2 Typen von Stichproben: 15 Stichproben, die 1998 entnommen, zuvor analysiert worden sind und eine unsichere Vorgeschichte aufweisen, 26 Stichproben von Rispen, die im Jahre 2000 von der Firma Testapi entnommen worden sind und eine gute Rückverfolgbarkeit aufweisen (16 mit Gaucho-Behandlung im Jahr der Stichprobenentnahme, 10 unbehandelte) (siehe Anhang XIII). Die fünfzehn Stichproben aus dem Jahre 1998 wurden erneut analysiert, wobei eine starke je nach Jahr der Mengenbestimmung eine erhebliche Schwankungsbreite bei den Imidaclopridgehalten festgestellt worden ist. Wegen der Unsicherheiten und Zweifel in Verbindung mit einigen Stichproben, wird empfohlen, für die Bestimmung der Imidaclopridmenge in den Maisrispen aus dem Jahre 2000 nur die Ergebnisse der Mengenbestimmungen in den 26 neuen Stichproben zu berücksichtigen, die von Testapi entnommen worden sind. Die berechneten Gehalte sind in Tabelle XIII angegeben.
Nur eine Stichprobe ohne Behandlung mit Gaucho im Jahr der Stichprobenentnahme durch Testapi wurde aus dem Boden entnommen, auf dem im Vorjahr mit Gaucho behandelter Mais angebaut worden war. Es ist daher auch hier unmöglich Rückschlüsse hinsichtlich eines möglichen „Anstiegs“ von Imidacloprid in die Maisblüten zu ziehen.
Andere Pflanzen als Sonnenblumen und Mais =
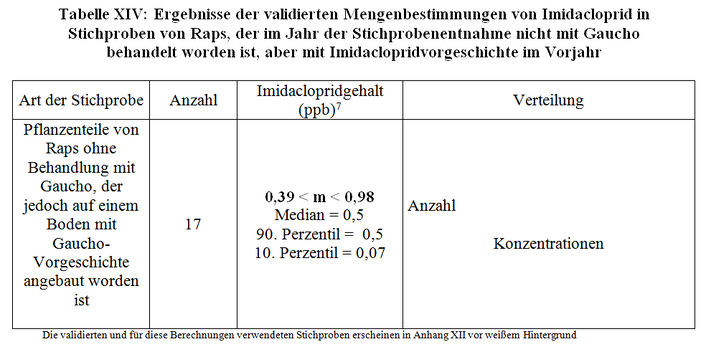
Stichproben von Raps, der im Jahr der Stichprobenentnahme nicht mit Gaucho behandelt worden ist, aber auf Böden angebaut wurde, auf denen im Vorjahr gebeiztes Saatgut (Weizen, Gerste) ausgebracht worden ist, erscheinen ebenfalls in den Berichten M17 und M21 und M150. Wir haben beim Vergleich mit den Datenblättern über die Stichprobenentnahme keine Unsicherheiten hinsichtlich ihrer Vorgeschichte festgestellt. Die berechneten, durchschnittlichen Imidaclopridgehalte erscheinen in der Tabelle XIV. 95% weisen Imidaclopridgehalte auf, die unter der Quantifizierungsgrenze liegen.
Die Studien, die sich mit der Aufnahme von Imidaclopridrückständen durch Weizen und Luzerne beschäftigen, konnten auf Grund der geringen Anzahl von Stichproben nicht validiert werden.
Kommentare und Perspektiven
Die angestellten, zahlreichen Mengenbestimmungen liefern uns leider nur Teilergebnisse, die zudem untereinander kaum vergleichbar sind. Nur die Studien, die vom Labor CNRS/CBM geleitet worden sind, ermöglichen nach Behebung der Unsicherheiten im Zusammenhang mit dem Typ der Stichproben einen insgesamten Überblick über die Imidaclopridmengen, die in den oberen Teilen der Pflanze im Laufe des Wachstums vorhanden sind. Bei den Pflanzenteilen von Sonnenblumen erlauben die validierten Stichproben die Feststellung (mit den voranstehend angegebenen Vorbehalten) von globalen Imidaclopridgehalten von ungefähr 4,2 ppb bei den Blütenständen von Sonnenblumen, die im Jahr der Stichprobenentnahme behandelt worden sind und von 6,5 ppb in den Blättern. Dieses Ergebnisse sind im Hinblick auf die Möglichkeit eines Verzehrs von Nektar außerhalb der Blüten durch die Bienen hervorzuheben, der insbesondere bei Sonnenblumen gegeben sein kann. Dieser Nektar, der von den jungen Sonnenblumen im Bereich der Unterseite der Blätter abgesondert wird, könnte auf Grund des frühen Zeitpunkts der Sekretion erhebliche Mengen an Imidacloprid enthalten. Ebenfalls festzustellen ist, dass in den Stichproben von Sonnenblumen eine Mengenbestimmung der Metaboliten des Imidacloprids vorgenommen worden ist. Da die Methode nicht spezifisch genug war (LQ = 10) verfügen wir über keinerlei gültige Daten über das Vorhandensein der Metaboliten in den Pflanzen. Es ist eine Konzentration von Imidacloprid in den Rispen von Mais mit einem durchschnittlichen Gehalt von 7,5 ppb festzustellen. Die übrigen Pflanzenteile (Stängel. Blätter, männliche Teile) enthalten ebenfalls nicht zu vernachlässigende Mengen an Imidacloprid (im Bereich von 3 ppb). Desgleichen verfügen wir über keinerlei Daten bezüglich der Möglichkeit einer Absorption von Imidaclopridrückständen durch Pflanzen (mit Ausnahme von Raps), die im Jahr der Stichprobenentnahme nicht mit Gaucho behandelt worden sind.
Die Experten des CST empfehlen deshalb:
- die Entwicklung einer Technik für die Mengenbestimmung der Zerfallsprodukte im Hinblick auf die Daten der chronischen Toxizität und der subletalen Auswirkungen.
- die Fortsetzung der Mengenbestimmungen in den Pflanzenteilen, die von den Bienen aufgesucht werden (Pollen, Nektar) von Sonnenblumen und Mais, die mit Gaucho behandelt worden sind und extrafloralen Nektar enthalten.
- die Fortsetzung der Mengenbestimmungen in den verschiedenen Teilen von Sonnenblumen und Mais, die im Jahr der Stichprobenentnahme nicht mit Gaucho behandelt worden sind, aber auf Böden angebaut wurden, die in früheren Jahren mit Gaucho behandelt wurden.
Die Stichprobenentnahmen erfolgen in Übereinstimmung mit den PBL.
Bewertung der Mengen an möglicherweise kontaminiertem Pollen und Nektar, die zum Bienenstock gebracht werden
Die Imidaclopridmenge, die in ein Bienenvolk eingebracht werden kann, ist sehr variabel und hängt von den Typen und von der Oberfläche der behandelten Kulturen ab, die in seiner Umgebung vorhanden sind, sowie von den Sammelentscheidungen der Arbeitsbienen hinsichtlich des eingesammelten Pollens und/oder Nektars. Der Sammelradius der Arbeitsbienen kann von mehreren hundert Metern bis zu einigen Kilometern betragen, abhängig von den Bedürfnissen des Bienenvolks und von den Ressourcen, die in der Umgebung vorhanden sind. So beträgt beispielsweise bei einem Aktionsradius von 200 m die abgesuchte Fläche 0,13 km², bei einem km beträgt sie 3,14 km², bei 5 km Radius sind es 78,5 km². Bei 6200 Beobachtungen hat Frisch (1967, A173) nachgewiesen, dass 20% der Bienen in Abständen von mehr als 2 km sammelten. Kürzlich hat eine Studie ergeben, dass die Bienen höhere Flugentfernungen zurücklegen können, die zwischen 6 und 7,5 km betragen (Beekman und Ratnieks 2000, A144). Wenn innerhalb des Sammelgebiets nur wenige behandelte Kulturen vorhanden sind, ist ganz klar, dass das Risiko geringer ist, als wenn sie zahlreicher sind. Diese Tatsache in Erinnerung zu rufen ist dennoch wichtig, weil die Tatsache, dass es sehr schwierig oder gar unmöglich ist, die Sammeltätigkeiten auf freiem Feld zu kontrollieren, die zahlreichen Unterschiede erklären könnte, die bei der Bienensterblichkeit von den Imkern ebenso wie von den Forschern bei Versuchen auf freiem Feld festgestellt worden sind.
Das Imidacloprid, das im Pollen und im Nektar (und später im Honig) vorhanden ist, könnte toxische Wirkungen nach sich ziehen, die sich mehr oder weniger langfristig bei bestimmten Kategorien von Arbeitsbienen (Ammenbienen, Feldbienen) zeigen. Wenn die von den Bienen zurückgebrachten Insektizidmengen hoch sind und nach der Ernte schnell konsumiert werden, könnte die Zahl der toten Bienen hoch sein und zu einer Verringerung der Population führen. Dieses Bienensterben könnte verzögerte Auswirkungen auf das Bienenvolk haben, zum Beispiel im Herbst oder im Winter, wenn die Bienen die Honigreserve verzehren, oder am Ende des Winters, wenn sie für die Aufzucht der neuen Brut den Pollen verzehren.
Im Falle des Pollens
a) Jährlicher Polleneintrag in das Bienenvolk
Die Pollenmenge, die jährlich von den Bienen geerntet wird, liegt in einer Größenordnung von mehreren Dutzend Kilo und kann bis zu 55 kg betragen (Louveaux, 1968, A83; Seeley, 1985, A84; Winston, 1987, A85). Es handelt sich um eine Mischung, die aus einer Vielzahl von Pflanzentypen stammt. Unter den Pflanzenpollen, die von den Bienen geerntet werden und mit Imidacloprid kontaminiert sein können, sind die Pollen von Sonnenblumen und Mais im Überfluss vorhanden (Louveaux, 1985, A91; Pham-Délègue und Ramirez-Romero, 2002; M106 Odoux et al. 2003, A159). Die Menge an Pollen von Mais und Sonnenblumen, die in den Bienenstock gebracht wird, hängt natürlich von der Gesamtanbaufläche dieser beiden Kulturen im Umfeld des Bienenvolks ab. Um den Polleneintrag zu quantifizieren, verwendet man Pollenfallen. Die Pollenfallen werden am Eingang des Bienenstocks aufgestellt und besitzen ein Gitter, das mit Löchern für die Bienen ausgerüstet ist. Beim Passieren dieser Löcher lassen die Bienen einen Teil des transportierten Pollens fallen. Die Pollenmenge, die in den Fallen eingesammelt wird, hängt von der verwendeten Fallenart ab. Früher lieferten die verwendeten Fallen eine Ausbeute in einer Größenordnung von 10% (Louveaux, 1968, A83). Heute scheint es, dass die Ausbeute bestimmter Fallen zwischen 20% und 40% beträgt (Fert und Marty, persönliche Mitteilung). Wenn man die Pollenmenge kennt, die in den Fallen aufgefangen wird, kann man somit grob die Pollenmenge abschätzen, die in den Bienenstock transportiert worden ist.
Der Pollen aus Pollenfallen ist eine Stichprobe dessen, was die Bienen in ihrer Umgebung einsammeln (in einem Radius von einigen hundert Metern bis zu mehreren Kilometern) und in den Bienenstock bringen. Wenn sich der Bienenstock in einem Gebiet mit Pflanzenkulturen befindet, die (mit unterschiedlichen Pestiziden) behandelt worden sind, oder nicht behandelt worden sind, bilden die Pollenkugeln, die von den Forschern eingesammelt werden, somit eine Mischung von Pollen aus unterschiedlichen Quellen.
Neuere Untersuchungen haben die tägliche Ernte von Mais und Sonnenblumenpollen während der Blütezeit dieser Pflanzen untersucht. -1/ Die erste Untersuchung bezog sich auf 24 Bienenvölker (ACTA, 1998, M32, M166 und M170; AKTA, 1999, M232), aber uns liegen nur die detaillierten Ergebnisse für 18 von ihnen vor (Vendée Marais, Vendée Plaine und Indre). Die Gesamtmenge an Pollen, der in den Pollenfallen während der gesamten Blütezeit dieser Pflanzen geerntet worden ist, variiert zwischen 0,85 und 4 kg/Bienenvolk. Da die von CNEVA verwendete halb quantitative Pollenanalysemethode nicht die Genauigkeit einer quantitativen Analyse erreicht, sind die jeweiligen Mengen der verschiedenen Pollentypen nicht bekannt. Gleichwohl stammte der Hauptteil der vorgefundenen Pollen im Allgemeinen von Sonnenblumen.
-2/ Die zweite Untersuchung bezog sich auf 20 Völker (Syndicat d’Apiculture du Lot et Garonne, 1998, T2). Die in den Pollenfallen geernteten Pollenmengen variierten zwischen 0,1 kg und 3 kg/Bienenvolk bei den Sonnenblumen und zwischen 0,02 kg und 3,8 kg beim Mais während der gesamten Blütezeit dieser beiden Pflanzen. Die verwendete Pollenanalysemethode ist nicht angegeben.
-3/ Die dritte Untersuchung hat die Pollen analysiert, die in den Pollenfallen von 10 Bienenvölkern geerntet worden sind und zwar von 2 Völkern im Jahre 2001 und 8 Völkern im Jahre 2002 (Odoux et al. 2003, A159), die inmitten von großen Anbauflächen (Mais, Raps und Sonnenblumen) aufgestellt worden waren. Diese Untersuchung hat zwei interessante Punkte ergeben: – Die Ernte des Sonnenblumenpollens erstreckt sich von Ende Juni bis Mitte September, die Ernte von Maispollen von Mitte Juli bis Anfang September. – Wenn die Pollenmenge anhand der Anzahl der Körner (durch Pollenanalyse auf Glasplättchen) bestimmt wird, unterschätzt sie im Allgemeinen das Gewicht des geernteten Sonnenblumen- und Maispollens, weil diese beiden Pollentypen größer als die anderen Pollentypen sind. Die von diesen Autoren verwendete Methode ermöglicht diesmal eine Berücksichtigung der tatsächlichen Masse des gesammelten Pollens. So haben die Autoren in den Pollenfallen von Bienenvölkern, die im Bereich großer Anbauflächen aufgestellt worden waren, 90% Sonnenblumenpollen und 80% Maispollen zum jeweiligen Zeitpunkt der Blüte dieser beiden Kulturen gefunden.
Sonnenblumenpollen
Die Sonnenblumenpollen produzieren während eines Zeitraums von etwa fünfzehn Tagen Pollen (Pham-Délègue und Bonjean, 1983, A87). Da eine zeitliche Verschiebung der Blütezeit von Anbaufläche zu Anbaufläche oder zwischen mehreren Sonnenblumensorten gegeben ist, kann sich der Zeitraum für die Ernte des Pollens bei einem Bienenvolk über ungefähr zweieinhalb Monate erstrecken (Odoux et al. 2003, A159). Je nach Ausbeute der Pollenfalle kann man die Menge an Sonnenblumenpollen berechnen, die von den Bienen geerntet worden ist. -1/ Die Ergebnisse von ACTA (1998, M32, M166 und M170; ACTA, 1999, M232) können nicht verwendet werden, weil der Anteil der Sonnenblumenpollen, die in den Pollenfallen geerntet worden sind, nicht bekannt ist.
-2/ Den Ergebnissen des Syndicat d’Apiculture von Lot et Garonne zufolge (1998, T2) variiert die Menge zwischen 0,5 kg und 15 kg / Bienenvolk, wenn die Falle eine Ausbeute von 20% liefert und zwischen 0,25 und 7,5 kg / Bienenvolk, wenn die Ausbeute 40% beträgt.
-3/ Den Ergebnissen von Odoux et al. zufolge (2003, A144) beläuft sich der volumenbezogene Anteil des Sonnenblumenpollens an dem in den Pollenfallen während der Blütezeit von Sonnenblumen geerntete Pollen auf 90%.
Maispollen
Die Produktion an Maispollen ist sehr hoch, und dieser wird von den Bienen in reichlicher Menge geerntet (Louveaux, 1985; A91, Pham-Délègue und Ramirez-Romero, 2002, M106).
1-/ In Frankreich zeigen die Daten, die von der Firma Michaud (größter Händler für französischen Honig) gesammelt worden sind, dass alljährlich zwischen 30 und 40% der französischen Bienenvölker mit Maispollen in Kontakt kommen (GDSA, 2001, T1).
-2/ In der oben genannten Untersuchung (Syndicat d’Apiculture von Lot et Garonne, 1998, T2) belaufen sich die Anteile an Sonnenblumenpollen und Maispollen in der Mischung auf jeweils 38 und 62%. Die Autoren haben auch festgestellt, dass „die Bienen ab dem Zeitpunkt der Maisblüte dem Sonnenblumenpollen den Rücken kehren und Maispollen sammeln“. Abhängig von der Ausbeute der Pollenfalle kann man die Menge an Maispollen berechnen, die von den Bienen im Bienenstock gelagert wird. Wenn die Ausbeute der Falle 20% beträgt, variiert die Menge zwischen 0,1 und 19 kg / Bienenvolk; wenn sie 40% beträgt, variiert die Menge zwischen 0,05 und 9,5 kg / Bienenvolk.
-3/ Den Ergebnissen von Odoux et al. zufolge (2003, A144), beläuft sich der volumenbezogene Anteil des Maispollens an dem in den Pollenfallen während der Maisblüte geerntete Pollen auf 80%.
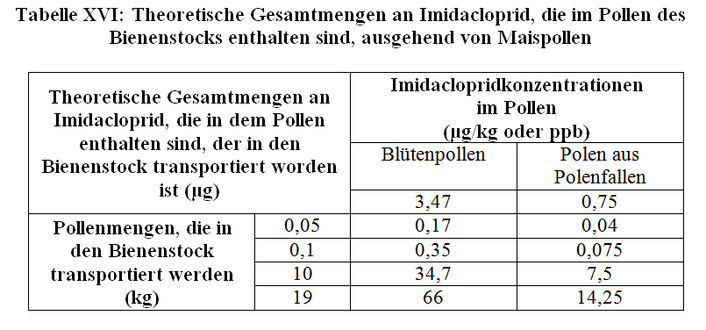
b) Theoretische Schätzungen der Imidaclopridmengen, die in den Bienenstock eingetragen werden
Sonnenblumenpollen
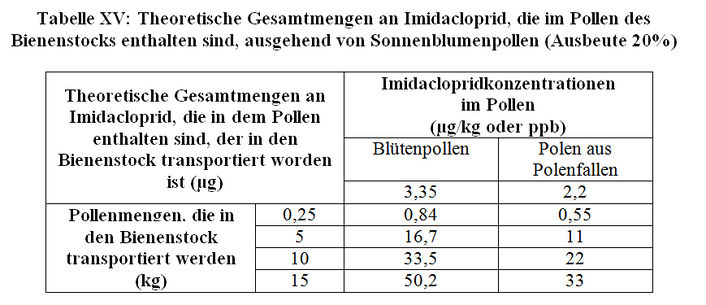
In Anbetracht der validierten Daten über die Bestimmung der Imidaclopridmenge in Pollen von Sonnenblumen, die mit Gaucho behandelt worden sind (zwischen 3,3 und 3,4 ppb, entsprechend einem Durchschnittswert von 3,35 ppb beim Blütenpollen und zwischen 2,1 und 2,3 ppb, entsprechend einem Durchschnittswert von 2,2 ppb, beim Pollen aus der Pollenfalle); siehe Absatz 2.1.1) und in dem Wissen, dass die Bienenvölker zwischen 0,25 und 15 kg Sonnenblumenpollen pro Jahr in den Bienenstock bringen, können wir die theoretischen Imidaclopridmengen schätzen, die in den Bienenstock eingetragen werden (siehe Tabelle XVI). Es ist wichtig hervorzuheben, dass die Ergebnisse der Bestimmung der Imidaclopridmenge im Pollen aus der Polenfalle auf einer Menge an gemischtem Pollen beruhen, was eventuell zu einer Unterschätzung des Imidaclopridgehalts im Pollen von Sonnenblumen mit Gaucho-Behandlung führen kann. Im übrigen zieht das Vorhandensein von Pollenfallen Störungen im Bereich der Aktivitäten des Bienenstocks nach sich. Es kann sein, dass der Pollen aus der Pollenfalle für die eingetragenen Imidaclopridmengen quantitativ nicht repräsentativ ist.
Später, wenn die chemische Stabilität des Imidacloprids in dem gelagerten Pollen bewertet worden ist, kann das obige Modell für die Quantifizierung von Imidacloprid im Pollen nötigenfalls revidiert werden.
Maispollen
In Anbetracht der validierten Daten über die Bestimmung der Imidaclopridmenge in den Pollen von Mais, der mit Gaucho behandelt worden ist (zwischen 3,28 und 3,65 ppb, entsprechend einem Durchschnittswert von 3,47 ppb beim Blütenpollen, und zwischen 0,69 und 0,81 ppb, entsprechend einem Durchschnittswert von 0,75 ppb beim Pollen aus Pollenfallen; siehe Absatz 2.1.1) und in dem Wissen, dass die Bienenvölker zwischen 0,05 und 19 kg an Maispollen pro Jahr herantransportieren, können wir die theoretischen Imidaclopridmengen schätzen, die in den Bienenstock eingetragen werden (siehe Tabelle XVI.
Es ist wichtig hervorzuheben, dass die Ergebnisse der Bestimmung der Imidaclopridmenge im Pollen aus der Polenfalle auf einer Menge an gemischtem Pollen beruhen, was eventuell zu einer Unterschätzung des Imidaclopridgehalts im Pollen von Mais mit Gaucho-Behandlung führen kann.
Im Falle des Nektars und Honigs aus Sonnenblumen
Die Menge an Sonnenblumennektar, die in den Bienenstock transportiert wird, ist schwer zu schätzen, weil sie von zahlreichen Faktoren abhängig ist (Sorten, Klima, Bodenkunde usw.), die wiederum variabel sind.
Mit diesem Nektar wird auf zweierlei Art verfahren: einerseits wird er in unveränderter Form von den Bienen verzehrt und andererseits wird er durch Enzymwirkung und Verdunstung von ungefähr 60% Wasser in Honig umgewandelt (Maurizio, 1976, A92). Den Honig, der im Gehäuse des Bienenstocks vorhanden ist, lässt der Imker den Bienen für ihren eigenen Verbrauch. Der in den Waben gelagerte Honig dagegen wird vom Imker geerntet. Wir kennen die Mengen an Nektar nicht, die von den Bienen in den Bienenstock transportiert werden. Der einzige Wert, über den wir für einen bestimmten Bienenstock verfügen, ist die Menge an Honig, die vom Imker geerntet wird. Beim Sonnenblumenhonig liegt diese im Allgemeinen zwischen 20 und 80 kg / Jahr; dieser letztgenannte Wert scheint seit einigen Jahren nicht mehr erreicht zu werden. Daher erfolgen die Berechnungen mit einem Höchstwert von 40 kg Sonnenblumenhonig.
Der Anteil des nicht verarbeiteten Nektars ist nur schwer genau zu bestimmen. Er wird von Seeley (1995, A82) grob auf 60% geschätzt. Bei einer Ernte von 120 kg Nektar würden dabei beispielsweise 70 kg von den Bienen unverändert verzehrt und 50 kg würden zu 20 kg Honig verarbeitet. Diese Daten beruhen jedoch nur auf einem einzigen bibliographischen Verweis, der sich zudem nicht auf Sonnenblumenhonig bezieht; es handelt sich dabei somit nur um einen Hinweis, der später noch präzisiert werden muss. Zusätzliche Studien wären notwendig, um den Anteil des Nektars zu bestimmen, der in unverändertem Zustand verzehrt und nicht zu Honig verarbeitet wird.
Fall des Nektars
Für die Berechnung der Imidaclopridmenge, die in dem Nektar enthalten ist, der in unverändertem Zustand von den Bienen verzehrt wird, wählen wir als Beispiel (Tabelle XVII) willkürlich den Fall von 2 Bienen aus, bei denen der Imker 20 kg (Volk A) bzw. 40 kg (Volk B) Honig geerntet hat. Die Menge an Nektar, die von den Bienen verzehrt worden ist, wird anhand der Schätzungen von Seeley (1995, A82) (mit den von uns unterstrichenen Vorbehalten) anhand der Menge an produziertem Honig geschätzt. Da nur eine einzige Untersuchung des Gehalts an Imidacloprid im Nektar von Sonnenblumen validiert worden ist (siehe Absatz 2.1.2), werden wir die theoretischen Imidaclopridmengen, die im Sonnenblumennektar vorhanden sind, der im Bienenstock gespeichert wird, anhand dieses Wertes von 1,9 ppb (Tabelle XVIII) schätzen. Wenn die chemische Stabilität des Imidacloprids in dem im Bienenstock gelagerten Nektar bewertet worden ist, kann das nachstehend dargestellte Modell für die Quantifizierung des Imidacloprids im Nektar nötigenfalls revidiert werden. 
Fall des Honigs
Für die Berechnung der Imidaclopridmenge, die in der Honigreserve enthalten ist, die von den Bienen verzehrt wird, interessieren wir uns nur für den Honig, den der Imker im Gehäuse des Bienenstocks belässt (und nicht für den Honig, den er in den Waben erntet). Ein Standardbienenkorb enthält 10 Rahmen. Jeder Rahmen ist durchschnittlich mit 1,5 bis 3 kg Honig gefüllt, was zwischen 15 und 30 kg Honig für den Verbrauch der Bienen ergibt (Jean-Prost, 1979, A93). Dieser Honig kann von mehreren Blumensorten stammen und insbesondere Sonnenblumenhonig in variablen Mengen enthalten.
Hinweishalber und als Arbeitshypothese können wir alle diese Daten verwenden, um ein Modell für die Kontaminierung der Honigreserve in einem Bienenstock vorzuschlagen. Bei dem nachfolgenden Beispiel werden wir nicht vom Extremfall einer Honigreserve ausgehen, die nur aus Sonnenblumenhonig besteht. Es versteht sich von selbst, dass dieser Fall unter natürlichen Bedingungen vermutlich nicht häufig vorkommt (außer vielleicht in bestimmten Regionen) und dass die Honigreserve aus einer Mischung von unterschiedlichen Blütenhonigen besteht, die nicht alle mit Imidacloprid kontaminiert sind.
Da bei der Verarbeitung von Nektar zu Honig ein Gewichtsverlust von 60% gegeben ist, stammen 15 bis 30 kg Honig somit aus 37,5 bis 75 kg Nektar. Bei einer Konzentration von 1,9 ppb Imidacloprid im Nektar beläuft sich somit die theoretische Imidaclopridmenge, die in der Honigreserve des Bienenstocks enthalten ist, auf 71,25 bis 142,5 µg. Später, wenn die chemischen Stabilitäten des Imidacloprids im Honig bewertet worden sind, kann das Modell für die Quantifizierung des Imidacloprids im Honig nötigenfalls revidiert werden.
Zusammenfassung der Daten über die Exposition bei Sonnenblumen und Mais
Validierungskriterien
Die Kriterien für die Validierung der Ergebnisse der Mengenbestimmungen bei Pollen, die von den Mitgliedern des CST herangezogen werden, lauten wie folgt:
- Nr. 1: eine ausreichende Zahl von Stichproben, die von verschiedenen Standorten stammen. In bestimmten Fällen (Mengenbestimmung in Nektar) können mehrere Versuche zusammengefasst werden, vorausgesetzt die Methoden für die Stichprobenentnahme und Mengenbestimmung sind einheitlich.
- Nr. 2: eine vollständige und eindeutige Vorgeschichte der Stichproben und Methoden für die Stichprobenentnahme, je nach untersuchtem Trägermaterial.
- Nr. 3: die Grenzen der Quantifizierbarkeit und Messbarkeit werden in den Studien angegeben und sind niedrig genug (LQ = 1 ppb; LD < 0,5 ppb), was die Untersuchungen der von den Bienen aufgenommenen Substanzen angeht.
- Nr. 4: eine spezifische Methode für die Mengenbestimmung von Imidacloprid und seiner Metaboliten, um die Unsicherheiten bei der Risikobewertung zu begrenzen (keine Mengenbestimmung von Gesamtrückständen).
- Nr. 5: ein Stichprobengewicht, das mit dem erforderlichen Gewicht für die Validierung der Methode übereinstimmt.
Mengenbestimmungen von Imidacloprid in den Pollen von Sonnenblumen und Mais:
Anzahl der Studien: 12
Für ungültig erklärte Studien: 8
Validierte Studien und Ergebnisse: 4
Mengenbestimmung von Imidacloprid im Nektar von Sonnenblumen
Anzahl der Studien: 6
Für ungültig erklärte Studien: 5
Validierte Studien und Ergebnisse: 1
Bestimmung der Imidaclopridmenge im Boden und Remanenz
Anzahl der Studien: 4
Für ungültig erklärte Studien: 2
Bestimmung des Imidaclopridgehalts in den Pflanzenteilen von Sonnenblumen und Mais, die nicht von Bienen aufgesucht werden
Anzahl der Studien: 8
Für ungültig erklärte Studien: 6
Validierte Studien und Ergebnisse: 2



